概論
新たなるステージに向かう
がん微小環境の理解と治療への応用
Towards new era of cancer microenvironmental research
藤田直也
Naoya Fujita:The Cancer Chemotherapy Center, Japanese Foundation for Cancer Research(がん研究会がん化学療法センター)
はじめに
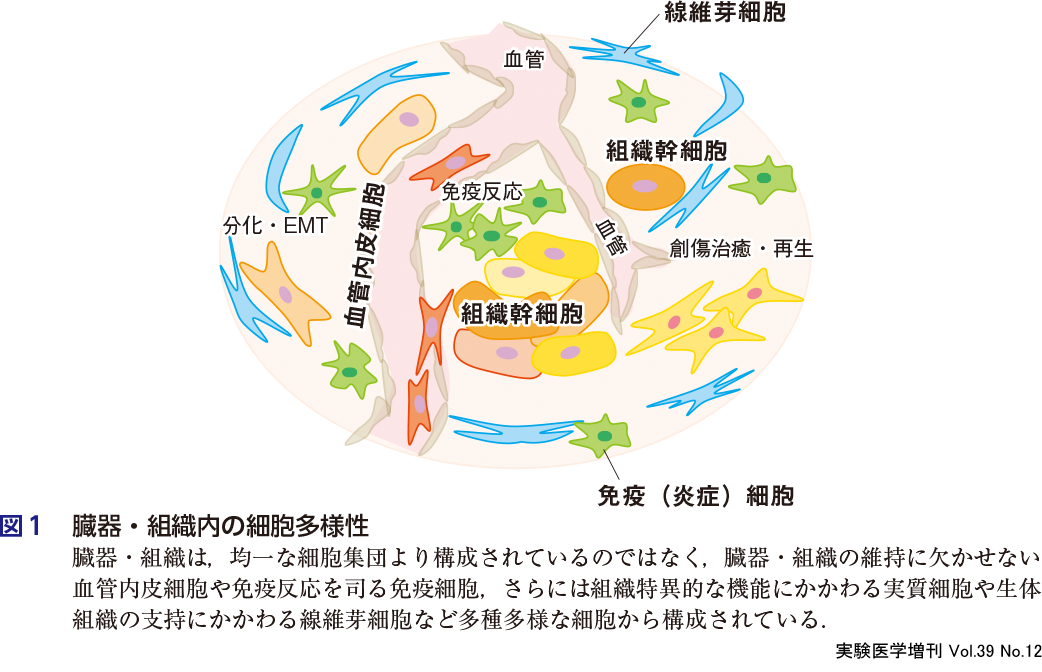
人体は約37兆個の細胞から構成されているとされるが1),それらの細胞は均一ではなく多様性に富んでいる.生体を構成する臓器・組織も,多様性に富む細胞から構築されており,こうした多様性こそが,環境変化に耐えうる強靭な(ロバストな)臓器・組織の維持と構築に貢献している(図1).腫瘍組織も,正常臓器と同様に宿主由来の非がん細胞である線維芽細胞,免疫細胞,血管内皮細胞などを含む組織として構築されており,がん細胞と宿主由来の非がん細胞との相互作用を含むがん微小環境は腫瘍増殖に不可欠な役割を果たしている.しかし,多種多様な細胞が入り混じった腫瘍組織のなかで,がん細胞の増殖を促進する非がん細胞との相互作用やがん微小環境をシングルセルレベルで解析することはこれまでの技術では難しく,多くは腫瘍組織の塊(バルク)として解析されてきた.しかし近年のシングルセル解析技術の革新と発展により,徐々に腫瘍組織内におけるがん細胞の多様性とその相互作用の詳細が白日のもとにさらされてきている.こうした解析が進むことにより,各種がんに特異的な原発巣のがん微小環境や原発巣と転移巣のがん微小環境の相違などが明らかになるものと期待されている.現時点ではまだ報告が少ない,がん細胞と非がん細胞の空間的な位置情報をも含んだ相互作用に関する研究も劇的に進むものと期待されており,がん微小環境に関する研究は新たなステージに向かっていることは間違いがない.
1.がん微小環境による腫瘍増殖の促進
腫瘍組織内の線維芽細胞,血管内皮細胞,免疫細胞などは,正常組織で認められる細胞とは異なる性状を示すことが知られており,腫瘍組織内の線維芽細胞はがん関連線維芽細胞(CAF)とよばれ,がんの悪性化などに関与している(第1章-6および第3章-5参照).腫瘍組織内の血管内皮細胞は,正常な血管内皮細胞とは異なる異常性を示すことが知られており,その異常性も含めてがん微小環境の制御に重要な役割を果たしている(第1章-11参照).また,腫瘍組織内のがん細胞は,分化段階や性質が不均一であることが詳しくみえてきている(第1章-1~6).免疫チェックポイント阻害剤のがん腫横断的な治療効果がクローズアップされてはいるが,単剤では半数以上の症例で無効であることなどから,がん微小環境内の免疫状態に関する研究が精力的に展開されている.これまでのところ,腫瘍内に浸潤している腫瘍浸潤リンパ球(TIL)の解析よりTILの疲弊化が見出されており,こうしたがん微小環境内の免疫疲弊化状態の構築には制御性T細胞(Treg)の腫瘍内浸潤が関与していることや(第2章-1~2),一部のTregではPD-1阻害薬投与により活性化されて抗腫瘍免疫を強く抑制してしまうこと(第2章-3)などが報告されている.NK細胞やNKT細胞など腫瘍抑制的に働く他の免疫細胞や,がん微小環境内の炎症シグナルや免疫応答を惹起する樹状細胞も,免疫チェックポイント阻害剤が効かない要因の1つと考えられており,その詳細な解析が進められている(第2章-4~6).このように,腫瘍組織内の微小環境は,正常な臓器・組織とは異なった特殊な微小環境を構成しており,そのためにがん微小環境と称されている(図2).
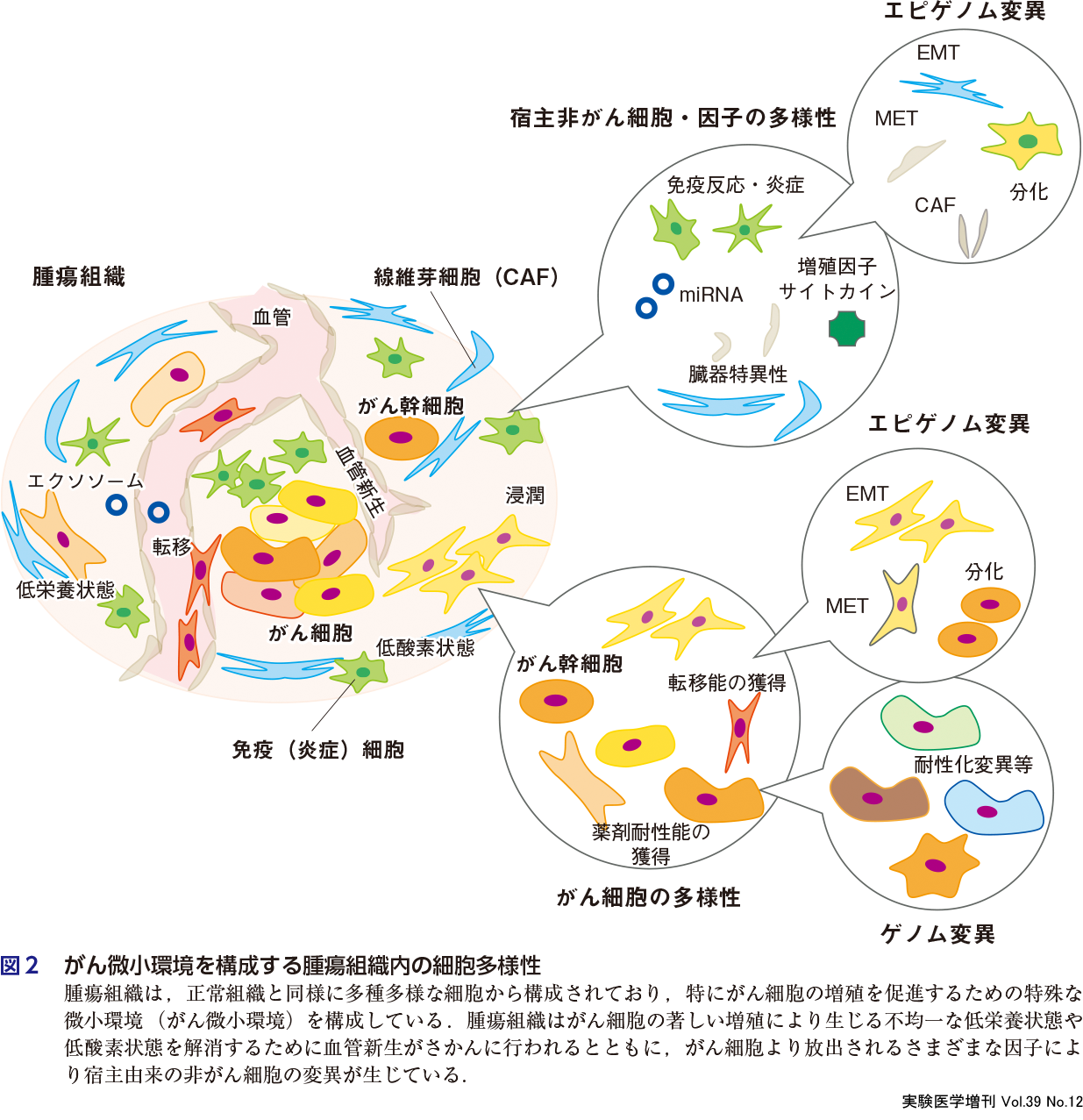
がん微小環境は腫瘍増殖の促進にかかわっているため,がん微小環境を標的にしたがん治療薬の開発といった応用面でも注目されている.一方で臨床で用いられている,さまざまな治療薬の多くはがん細胞を標的としており,これら治療薬への抵抗性(治療薬耐性)にもがん微小環境は関与している.そのようななか宿主由来の非がん細胞は,がん細胞に比べるとその変異頻度は低いため,新たながん分子標的としても注目されている.腫瘍組織内の非がん細胞を標的にしたがん治療薬としてよく知られているのは,VEGFの中和抗体であるベバシズマブである(第3章-3参照).ベバシズマブは腫瘍組織内での新生血管の形成を抑制することや腫瘍血管の正常化・成熟化を誘導してがん微小環境を正常化することで抗腫瘍効果を示すとされており,このことからもがん微小環境が腫瘍増殖を正に制御していることは明白である.特に近年では,腫瘍組織内の特異的な免疫微小環境や低酸素・低栄養環境,さらには間質細胞・血小板などの非がん細胞との相互作用の分子機構解明も進んでおり(第3章),こうした基礎研究が進むことで,新しい作用機序のがん治療薬の開発へと結びついていくものと思われる.
2.シングルセル解析技術の革新とがん微小環境のより精緻な理解
腫瘍組織内のがん細胞には多様性が認められることが,原発巣の複数領域からサンプリングした検体の全エクソンシーケンスの結果で明らかになっており(第2章-1参照),がん微小環境の不均一性ががん多様性をもたらすがん進化を促している可能性が示唆されている.近年のシングルセル解析技術の革新により,Fluidigm社のC1や10x Genomics社のChromiumといった機器を用いたシングルセル遺伝子発現解析(scRNA-seq)が可能になり,さらには得られたデータの解析手法が開発されたことで,がん悪性化にかかわるがん進化の詳細な理解に大きな貢献を果たしている.さらに最近では,セルソーター技術を基本とする画像活性セルソーターENMAやCyTOFといった機器によりシングルセルレベルの精緻なタンパク質発現解析が可能になってきている(第4章-5,6参照).しかし,個々の細胞の空間的位置情報(3次元情報)が解析過程で失われるというのがこれら解析機器の弱点であったが,その弱点を克服する可能性のある組織透明化技術の技術革新が非常に速いスピードで進んでいる(第4章-1,2参照).10x Genomics社からはVisiumという空間的位置情報を保持した遺伝子発現プロファイルを解析できるシステムも販売開始となっており,注目を集めている.CyTOF技術と組み合わせることにより組織スライド内の位置情報を保持した形でのタンパク質発現解析が可能となるHyperionなどの機器も商品化されており(第4章-6参照),近い将来にscRNA-seqデータと組み合わせることでがん微小環境のより精緻な解析が可能になるものと期待される.一方で,検体などからシングルセルを直接ピッキングする横河電機のサンプリング装置(第4章-4参照)やBerthold社のCC-1001,さらにはピックアップしたシングルセルをハンドリングするQuantum Design社のcellenONEやBLI社のBeaconなどの機器も相次いで商品化され,これまで謎であった原発巣内におけるがん微小環境の不均一性の解明やがん進化への関与に関する研究が進むことが期待される.
おわりに
シングルセル解析で得られる多細胞間の相互作用解析では,これまでのデータ量とは比べものにならないほどの大量のデータを取り扱う必要がある.これは天候予測や台風進路予測の際に用いられているスパコンレベルでの解析が必要になることを示している.誌面の都合上,残念ながら本特集では網羅できなかったが,こうしたビッグデータを扱える数学的な解析手法の確立と,数理モデルのシミュレーションによる検証が必要となる.すでに多くの数理研究者が生命現象の数学的解析と数理シミュレーションによる可視化の可能性を検討しており,今後のがん微小環境の研究にはこうした数学的な解析が不可欠になることは間違いがない.がん微小環境が再び特集テーマとして取り上げられる際には,がん微小環境の数理的解析結果やシミュレーション結果などを多く含んだ特集号になるであろう.また同様に本特集では取り上げることができなかったが,細胞を射出可能な3Dプリンター技術2)やスフェロイド積層技術3)を用いることで,立体的かつ機能的な臓器の再構築が可能になりつつあることを考慮すると(図3),がん微小環境の理解にこうした技術を取り込んだ研究も進展するものと考えられる.これら技術は腫瘍組織をin vitroで再現することにもつながるため4),近い将来には数理シミュレーション結果に基づいてバイオ3Dプリンターにて位置情報を含めて腫瘍組織を再構築し,シミュレーション結果を実験的に検証できるようになると期待される.本特集では,新たなるステージに向かうがん微小環境研究の現状を,最先端の研究を進めている先生方に執筆いただいた.本特集で整理された最先端の知見をもとに,がん微小環境研究がさらに発展し,がん根治への新たな道筋が示されることを期待したい.

文献
- Bianconi E, et al:Ann Hum Biol, 40:463-471, 2013
- Noor N, et al:Adv Sci (Weinh), 6:1900344, 2019
- Nakayama K : In Vitro Biofabrication of Tissues and Organs. 「Biofabrication─Micro- and Nano-fabrication, Printing, Patterning and Assemblies」(Forgacs G and Sun W, eds), pp1-21, William Andrew, 2013
- Augustine R, et al:Transl Oncol, 14:101015, 2021
<著者プロフィール>
藤田直也:1995年に東京大学大学院薬学系研究科博士課程修了後,同年より東京大学分子細胞生物学研究所の助手・助教授(医学系研究科・薬学系研究科・新領域創成科学研究科を兼担).2006年に(財)癌研究会癌化学療法センター基礎研究部部長として異動.’15年より現職である(公財)がん研究会がん化学療法センター所長.’17年からは文科省科研費新学術領域研究「細胞ダイバース」の領域代表を務め,生物学と数学の融合による組織構築の原理の解明をめざしている.