概論
GWASから迫る新たなバイオロジー
From GWAS to novel biology
鎌谷洋一郎
Yoichiro Kamatani:Laboratory of Complex Trait Genomics, Department of Computational Biology and Medical Sciences, Graduate School of Frontier Sciences, The University of Tokyo /Laboratory for Statistical and Translational Genetics, RIKEN Center for Integrative Medical Sciences(東京大学大学院新領域創成科学研究科複雑形質ゲノム解析分野/理化学研究所生命医科学研究センターゲノム解析応用研究チーム)
遺伝学とは,遺伝的継承(heredity)と多様性(variation)が織りなす遺伝現象を研究する学問である(概念図1).このうち遺伝的多様性を主な研究対象とする複雑形質(多因子形質)の研究手法として,大サンプルのゲノムデータと計算機を用いた解析を行うゲノムワイド関連解析(GWAS:genome wide association study)が広く行われ,糖尿病,心筋梗塞,関節リウマチ,気管支喘息,アルツハイマー型認知症,統合失調症,躁うつ病などの「ありふれた疾患」の感受性座位が多数判明した.その結果は幅広くインターネットを介して配布されている.これをさまざまな分野の研究者が今後の研究に活かしていくことは可能だろうか? 本特集は,GWASそのものの解説をするというよりは,GWASがすでに得られている状況で,今後の新たな展開の可能性について若手研究者に寄稿をいただいた.
はじめに
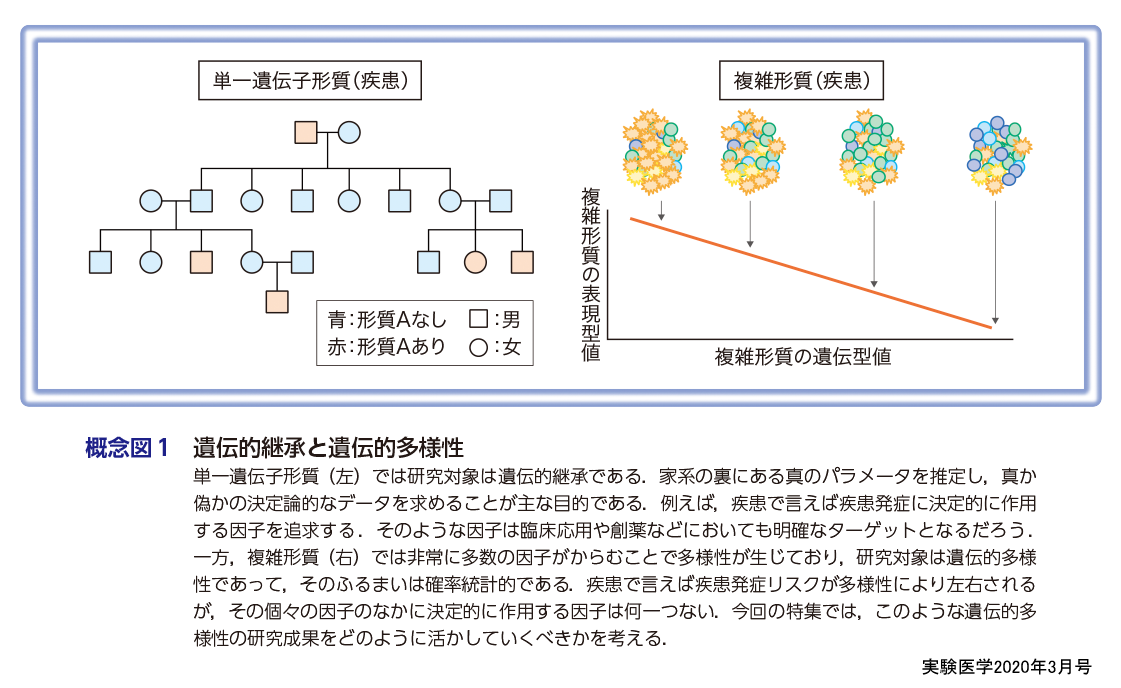
SNPアレイや次世代シークエンサーの実現化により,今世紀にはさまざまな疾患と関連する遺伝的配列情報の報告が相次いでいる.疾患遺伝学のなかでも生殖細胞系列ゲノムの研究としては,このうち遺伝的継承を主軸とする単一遺伝子疾患(形質)(概念図1)についての研究が先行しており,連鎖解析やエクソーム・シークエンスなどの多大な努力により多くの単一遺伝子疾患の原因遺伝子が判明している.一方,遺伝的多様性を主軸とするありふれた形質,これを英語complex traitの直訳として複雑形質とよぶことにするが,その研究が大きく花開くためには,多様性を把握するための十分なデータ量の取得と,ゲノム配列決定のコストが十分に下がる時代を待つ必要があった.
現在ではSNPアレイによる全ゲノムタイピングのコストは一人当たり数千円であり,次世代シークエンサーによる全ゲノムシークエンスも一人当たり10万円を切ってきている.こうして相対的に廉価に取得できるようになったゲノムデータを用いて,今や数十万人から数百万人というサンプルサイズのGWASが行われている.こうした人数のゲノムデータの収集を行うために,世界中のゲノムデータを統合する国際共同研究や,はじめから大サンプルの収集を目的としたバイオバンク,さらには数千万人ものゲノムデータを保有すると言われる民間企業も散見されるようになるなど新たな潮流も出現している.
このように進んできたGWAS結果は,GWAS Catalogサイト(https://www.ebi.ac.uk/gwas/)などで国際的に公開・共有が進んでおり,われわれのバイオバンク・ジャパンのゲノムデータを用いた日本人GWASの結果もGWAS Catalogのほか,NBDC(https://humandbs.biosciencedbc.jp/en/hum0014-v18)や理化学研究所JENGERサイト(http://jenger.riken.jp)から非制限公開されている.さらに,LD Hub(http://ldsc.broadinstitute.org/ldhub/)やMR-Base(http://www.mrbase.org)のように,公開されたデータをもとに解析をウェブ上で行うことを目的としたサイトも出現してきている.そのうえUK Biobank(https://www.ukbiobank.ac.uk)のように,個人別ゲノムデータそのものを世界中に分譲する機関も出現するようになってきた.
1GWASの直接的成果
GWASを行った結果,複雑形質には一つの形質あたり数十から数百のバリアントが関連することがあるとわかった.原因バリアント数は,緻密な遺伝統計学的推定によると,一つの形質について数千バリアントに上るものもありそうだ1).このようにきわめて多数の因子が特定の疾患に関連するとき可能性としては大雑把に2通りあって,一つは,これまで一つの疾患だと思われていたものはじつは個々の因子がそれぞれ強く影響して発症するきわめて異質的な疾患の集合であったというもの.もう一つは,個々の因子は影響力はとても弱くて独立したものだが,足し算のように集積的に一つの疾患を形成するというものである.これまでのGWASの成果をもとにすると,どうやら後者が正しいようだ.これはじつを言うと20世紀初頭から予測されていた遺伝的構造の一つで,ポリジェニック・モデルとよばれるものである2).
とはいえ,完全にそれだけで説明できるものではなく,なかには若年性心筋梗塞のLDLRやAPOA5上のバリアントのように,一般に複雑形質であると捉えられる疾患のなかには特定の強力なバリアントによってかなり説明できる個人が稀にいるとの報告もあり3),この場合は疾患集団のなかで異質性が生じている可能性がある.さらに,強力なバリアントをもち,かつポリジェニックな弱いバリアントの集積的効果もある時,とりわけ強いリスクを示すとの報告もある4).複雑形質の遺伝的構造はかなりわかってきたものの,まだ不明で解明が必要な部分が残っている.これまでGWASはSNPアレイを用いて行われてきたが,全ゲノムシークエンスによってさらに解明されていくと考えられる5).
2GWASバリアントの生物学的意味
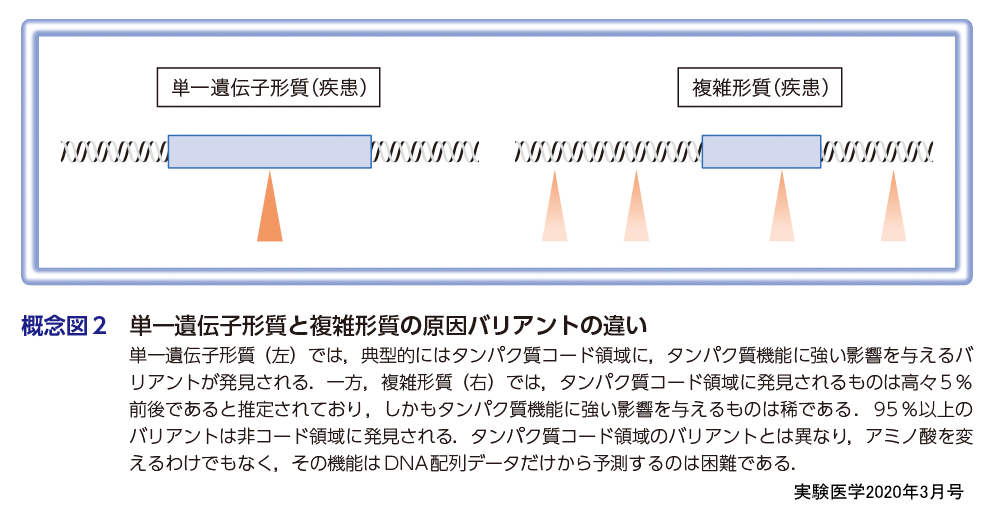
さて,単一遺伝子疾患のための連鎖解析やエクソームシークエンスにしても,複雑形質のためのGWASにしても,その第一の目的は同じで,感受性遺伝子座または原因バリアントを同定することである.すなわち,これらの手法は形質関連遺伝子のマッピング手法である.しかし当然ながら,マッピングするだけでは不十分で,そのバリアントは何をどのようにして疾患発症につながっているのかを生物学的・医学的に洞察することによってはじめて,診断・治療介入や,創薬へと結び付けていくことができるだろう.
単一遺伝子疾患の場合は,典型的には疾患について強力な影響をもつ単一のバリアントを検出するので,その単一の原因座位のクローニングを行ったり,単一の原因遺伝子や原因バリアントに着目して機能解析を行うことで,病態解明や創薬に結びついたり,診断・治療介入が計画されてきた.
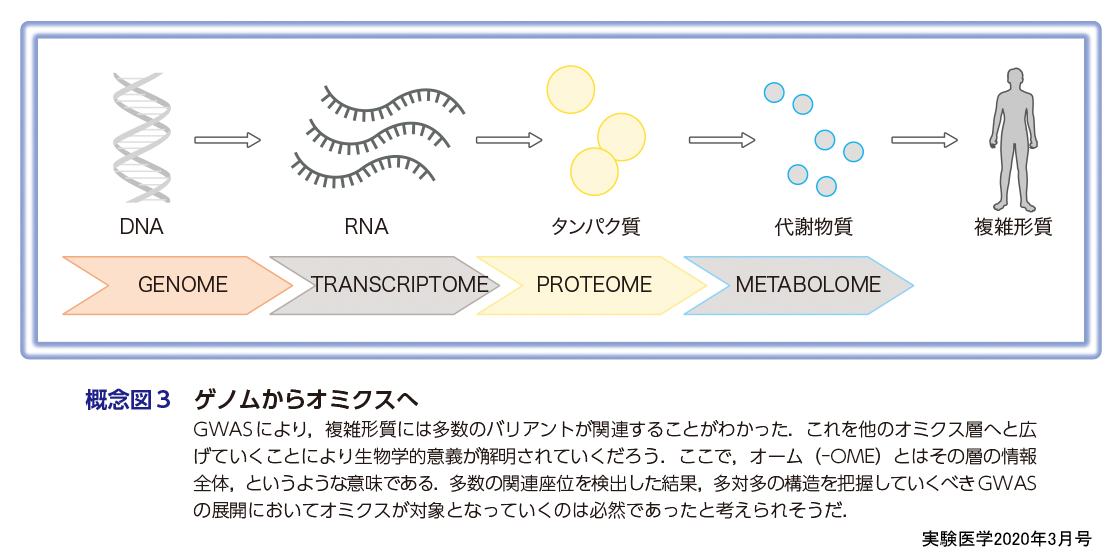
それに対して,GWASが明らかにした一疾患あたり数十〜数百もの感受性座位とは一体何なのだろうか.難しいことに,単純にたくさんあるというだけではなく,GWASバリアントは既知の単一遺伝子疾患の原因バリアントとは異なってほとんどは遺伝子コード部位には存在しないことがわかっている(概念図2)6).そもそもそれぞれのバリアントは,どの遺伝子をターゲットとしたバリアントであるのかすら,配列情報だけからは推定しづらい.原則として,非常に多数の遺伝的感受性バリアントと,複雑な細胞内ネットワークとの関係性を総体として解明していくことが必要になるだろうと筆者は考えている.それにもとづけば,ポストGWASの研究にはオミクス研究との統合が必須であると考えられる(概念図3)
楽観的に捉えると,GWASによって見つかった非コード領域の多数のバリアントとは,ヒトゲノムの98%以上を占める非コード領域を解明するための手掛かりでもあるのかもしれない.もしGWASというのが本当に正しい研究手法であるとするならば,非コード領域に見つかった95%ものバリアントは,細胞内で何らかの実質的な変化をきたすことにつながるゲノム領域である可能性が高い.それは何なのだろうか? GWAS結果を活かしたどのような研究を行うことができるのか.
3本特集の構成
このような問いを解くために,本特集では,我が国においてGWASの成果からさらなる次のステップに踏み出すことで複雑形質に関連する遺伝的バリアントの生物学的意義の解明を志す若手研究者に寄稿を依頼し,その理解を深める可能性について紹介していただいている.
まず秋山の稿では,GWASの結果として遺伝統計学的に同定される疾患感受性バリアントをどのように理解していくことで生物学とつなげていくことができるかについての基本的な知識,ならびに具体的な方法と注意点について論じてもらった.読者は遺伝的多様性情報とゲノム機能とを結びつける基本となる知識を得られるはずである.次に石垣の稿では最も正統で直接的なGWASの解釈,すなわち複雑形質のゲノム多様性はトランスクリプトーム多様性を引き起こすことにより疾患感受性につながっていると言う考え方について,コンセプトならびにその限界について解説いただいている.特に,この分野に限らず世界的な潮流となっているシングルセル解析を,GWAS結果とともに活かすにはどうすべきかの洞察をいただいた.ところで,ゲノム多様性がトランスクリプトームに影響を与えると言うことであるが,それはどのような理由で起こるのか.小口・村川の稿ではこれをエンハンサー多様性の面から論じていただき,とりわけ新しく解明されてきたエンハンサーRNA(eRNA)をもとに読み解く手法を紹介していただいている.その一方で,坂上・岡田の稿ではマイクロRNAの影響を検討する手法を紹介いただいたが,ここではGWASデータの洗練された利用法を学ぶことができると期待できる.
また,GWASデータをもとにさらなる解析へと進む方向性の例を挙げていただいたのが,残りの3稿である.寺尾の稿では,GWASを生み出すSNPアレイデータのその他の応用例として,アレイのシグナル強度情報を用いることによる体細胞モザイク研究を例に挙げて紹介していただいている.池田らの稿では,GWASによって得られたバリアントをもとにした洞察にもとづきリピドミクス研究へと広げる可能性を示していただいた.最後に,竹内の稿では,メチル化研究によりGWASを解釈するためのメンデル無作為化試験を,例を挙げて示していただいた.
おわりに
GWASは一つの疾患について数十から数百もの遺伝因子を検出したが,それが生物学的に何を意味しているかということはまだ十分解明されていない.一つひとつのバリアントの機能については徐々に解明が進むにしても,その後にはこのたくさんの遺伝因子を網羅的に解析することが必要となっていくのではないだろうか.実験とインフォマティクスはこれからますます融合していくことが望まれるだろう.今回の特集が,多くの研究者にGWAS結果に興味をもっていただくことにつながり,また研究を進めるヒントとなるところがあれば幸いである.
文献
- Yang J, et al:Eur J Hum Genet, 19:807–812, 2011
- Visscher PM & Goddard ME:Genetics, 211:1125–1130, 2019
- Do R, et al:Nature, 518:102–106, 2015
- Khera AV, et al:Cell, 177:587-596, 2019
- Timpson NJ, et al:Nat Rev Genet, 19:110–124, 2018
- Maurano MT, et al:Science, 337:1190–1195, 2012
著者プロフィール
鎌谷洋一郎:2002年,千葉大学医学部医学科卒業,臨床研修の後’09年,東京大学大学院新領域創成科学研究所博士課程卒業.その後フランスFondation Jean Dausset-Centre d'étude du Polymorphisme Humain(CEPH)にてMark Lathrop 教授に師事.’13年より理化学研究所統計解析研究チーム,’15年よりチームリーダー.’17年より京都大学医学研究科 准教授.’19年より東京大学大学院新領域創成科学研究科 教授.現在に至る.ゲノムとオミクスを統合し,細胞内ネットワークを解き明かしたい.