概論
「Inflammaging/炎症老化」を理解し老化の本質解明に迫る
Unraveling the essence of aging by understanding inflammaging
尾池雄一,真鍋一郎
Yuichi Oike1)/Ichiro Manabe2):Department of
Molecular Genetics, Graduate School of Medical Sciences, Kumamoto
University1)/ Department of Systems Medicine, Graduate School
of Medicine, Chiba
University2)(熊本大学大学院生命科学研究部分子遺伝学講座1)/千葉大学大学院医学研究院疾患システム医学講座2))
さまざまな加齢関連疾患の共通基盤病態として,加齢に伴う慢性炎症「inflammaging/炎症老化」に注目が集まっている.加齢に伴い炎症が誘導されるメカニズムや組織・臓器間での差異,そしてその生体への影響について,以前は不明な点が多かった.しかし,シングルセル解析やオミクス解析など近年の科学技術の進歩により,inflammagingの実態が徐々に解明され,加齢関連疾患への治療戦略が見えつつある.本特集では,分野横断的に展開されるinflammaging研究の新たな知見を紹介し,老化の本質に迫る.
はじめに
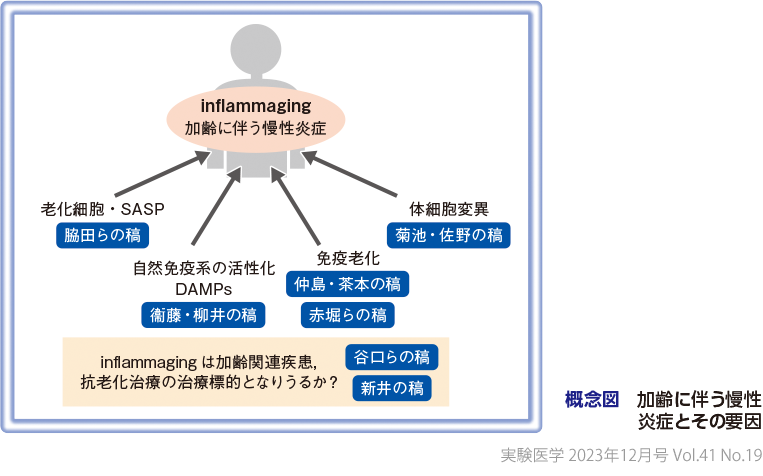
炎症反応は,感染や傷害に対して生体を防御し,組織を修復・治癒させるプロセスの初期に起こり,通常は一過性であり病原体が排除されれば急速に収束する.主に血管と免疫細胞の応答により,免疫細胞が局所に集積し,また血管透過性亢進により血中の生理活性物質も集まり,活性化した貪食細胞をはじめとする免疫細胞のネットワークにより病原体や死細胞を効率的に排除・処理する働きがある.一方,前世紀の動脈硬化研究等を嚆矢に,今世紀には生活習慣病やがんでも,低レベルの炎症の持続を特徴とする慢性炎症が生じていること,また慢性炎症が病態の発症と進展に寄与していることが次々に明らかとなった.生活習慣病やがんの多くは加齢とともに増加する加齢関連疾患であることから,加齢関連疾患と慢性炎症との関連が強く示唆される.興味深いことに,老化では獲得免疫応答能の減弱(immunosenescence/免疫老化)が認められ,易感染性をもたらすのに対し,一方で炎症が容易に誘導され,また慢性に遷延する(inflammaging/炎症老化)という一見相反する状態となることが明らかとなり,さまざまな加齢関連疾患の共通基盤病態として,老化に伴う免疫や炎症応答の変化に注目が集まるようになった.2013年にCell誌に発表された「老化を規定する9の要因(The Hallmarks of Aging)」1)に,「慢性炎症(chronic inflammation)」を含む新たな3要因が追加された「老化を規定する12の要因」として改訂バージョンが本年(2023年)1月号のCell誌に発表され2),慢性炎症が老化において重要な役割を果たしていることが確固たるものとなり注目されている.この注目が集まる老化に伴う慢性炎症や,慢性炎症を基盤としてさまざまな加齢関連疾患の発症リスクが高まる状態を引き起こすメカニズムは,単一なものではなく多様な要素がかかわっていると推察されているが,その解明は十分ではない.さらにこれまで,すべての組織,臓器で同じように慢性炎症が生じているのか,同一個体においても組織,臓器間でそのメカニズムに相違はあるのか,そもそも慢性炎症は生体にとって良いことなのか,それとも悪いことなのか等も十分には解明されていなかったが,近年その全貌が徐々に解明されてきている(概念図).
1慢性炎症をどう捉え,その要因をどう捉えるか
❶ 老化細胞の活性化
老化に伴う慢性炎症の要因の1つとして,老化細胞の蓄積が炎症を引き起こすことが示されている.2016年,「Naturally occurring p16Ink4a-positive cells shorten healthy lifespan」がNature誌に報告され,老齢個体からp16の発現を指標に老化細胞を除去すると,個体の寿命が延伸することが示され,細胞老化と個体老化が連関することがはじめて明確に証明された3).さらに別のグループからも,p16を発現している細胞を取り除くことで,加齢に伴うサルコペニアや白内障,脂肪減少などの老化表現型の出現が抑制でき,また,炎症マーカーも低下することが報告され,抗老化戦略として老化細胞除去 “senolysis” が注目されている.老化した細胞はsenescence-associated secretory phenotype(SASP)因子とよばれる炎症性のメディエーターやタンパク質分解酵素を分泌する形質を示すようになる4).SASP因子は,マクロファージ,顆粒球,NK細胞,T細胞等の免疫細胞をリクルートし,不要な老化細胞を除き,組織のリモデリングや再生を進めることから,SASP因子が分泌されることは,発生や組織修復に必須の生理的な応答と考えられる5).しかし,加齢に伴いこの炎症シグナルやプロセスの制御が適切に行われなくなることで,病理的な炎症をもたらし,その結果,がん,動脈硬化性疾患,肥満性代謝疾患などの発症リスクを高めることが解明されてきている(脇田らの稿).
昨年(2022年)末にNature誌に筋組織を対象としたシングルセル解析による老化細胞アトラスに関する論文が発表された6).慢性炎症の要因の1つである老化細胞は,老齢期であっても傷害のない筋組織にはほとんど存在しない(あるいは数が非常に少ない)が,傷害を受けると活性酸素とDNA損傷の蓄積により老化細胞の出現が増大し,炎症誘導を介して筋再生を阻害すること,逆に老化細胞の出現を抑制する,もしくは老化細胞からのSASP因子など炎症性因子の分泌を抑制すると,幹細胞の増殖が保たれ,筋再生が促進されること,老齢期にいったん老化細胞が出現すると,免疫系の機能が減弱しているため,老化細胞の除去ができず,老化細胞が残存する要因となることが示された.さらに老化細胞では,NF-κB,インターフェロン,SMADなど炎症性,線維化促進性の経路,因子が活性化されており,細胞老化が加齢や疾患状態で慢性的に生じることの有害性が示された.しかし一方で,若齢個体で一過性に生じる細胞老化は,幹細胞ニッチの構成細胞としての重要な役割を担うなど,組織再生の面での有用性が示され,慢性炎症の要因となる老化細胞はすべて有害であるという一般的な考えを覆した.さらに,老化細胞にも遺伝子発現のばらつきがあり単一ではないことが示されたことは,注目すべき知見である.他にも細胞老化が肝臓の線維化を制限する等,慢性炎症を進めるだけという単純な役割でないことがわかってきている.また,SASP因子に含まれる炎症性サイトカイン等は細胞老化にかかわらず発現機能するものであり,細胞老化に起因するかどうかには注意が必要である.
❷ 自然免疫系の活性化
炎症は内的・外的ストレスに対する代表的な生体防御反応であり,本質的に保護的・適応的な応答である.微生物感染や創傷などにより誘導される「急性炎症」は,いわゆる炎症の四徴(発熱・発赤・疼痛・腫脹)を呈する典型的な生体防御反応であり,一過性に誘導され,炎症反応のピークを越えると健常状態に復する.これに対して,老化や生活習慣病でみられる慢性炎症では,明らかな急性炎症の特徴(炎症の四徴)を示さないままに低レベルの炎症反応が長期にわたって持続・遷延化することが特徴である.低レベルであっても炎症の持続は,組織機能の変調と障害を引き起こし,長期的には線維化などの組織リモデリング(再構築)により不可逆な臓器の機能不全をもたらす.
自然免疫系は病原体の分子の特徴(pathogen-associated molecular patterns:PAMPs)を認識して感染への最初の防御を司る.マクロファージ等の自然免疫系の細胞はTLRに代表されるPAMPsを認識するさまざまな受容体(pattern recognition receptor:PRR)を発現する.PRRは病原体だけでなく,細胞死や組織傷害により細胞外に放出される分子(ダメージ関連分子パターン,damage/danger-associated molecular patterns:DAMPs)も認識して活性化される.老化や生活習慣病にみられる慢性炎症を引き起こす誘因の多くは非感染性(無菌性炎症)と考えられており,DAMPsが自然免疫系の病原体センサーにより認識され,炎症シグナルを活性化する.DAMPsには細胞死によって放出されるHMGB1や二本鎖DNAだけでなく,コレステロールや尿酸の結晶,さまざまに修飾された内因性分子も含まれることが知られている7).このようなDAMPsが加齢とともに,細胞死の増加や線維化により組織に集積する可能性がある.また,死んだ細胞は迅速に貪食細胞によって処理されるが,加齢に伴う貪食細胞の機能低下はDAMPsの増加をもたらすかもしれない.実際,加齢マウスでは急性炎症モデルにおいて,マクロファージがアポトーシスした顆粒球を処理する機能が低下し,炎症が収束しにくくなることが報告されている8).このようにマクロファージによる死細胞の処理は急性炎症の収束に必須である.動脈硬化巣では,アポトーシスした泡沫細胞(コレステロール等の脂質を過剰に取り込んで泡状になった細胞)がマクロファージによるクリアランス能力をオーバーして蓄積することにより,壊死コアが形成され,粥状硬化巣の発展やプラークの不安定化をもたらすことが提唱されている9).このように貪食細胞によるクリアランスは炎症にブレーキをかけ適切に収束させることに重要であり,その障害は炎症を遷延させることから,加齢による貪食細胞の機能低下は炎症の遷延化にも寄与している可能性が高い(衞藤・柳井の稿).
❸ 老化に伴う免疫の変容
獲得免疫系と自然免疫系両者の加齢に伴う内因性の変化(免疫老化)は慢性炎症状態の誘導に寄与している可能性がある.加えて,加齢に伴い免疫系を活性化する環境要因の変化も生じる.老化に伴い免疫系はその効率と正確性が低下することが知られており,このような加齢に伴う変化をimmunosenescence/免疫老化とよぶ10).例えば,ワクチンや新しい病原体への反応が低下する.しかし免疫応答が全般的に低下するのではなく,炎症を推進・抑制するネットワークの変調・機能異常により,免疫応答の制御異常が生じ,低レベルの炎症状態の持続や,一部の自己免疫疾患のリスク増大ももたらす.
免疫老化の1つの特徴は獲得免疫系の変化である.ナイーブT細胞,B細胞数が低下し,メモリー細胞が増加,T/B細胞受容体のレパートリーは減少する.この変化が,新規抗原への応答性の低下をもたらす.
自然免疫系の細胞については,リンパ球の造血は低下し,骨髄球系の造血へとシフトすることもあり,加齢に伴う数の低下はみられない11).一方で自然免疫系の一部機能は低下する.例えば,樹状細胞がT細胞へ抗原を提示する能力が低下し,単球の貪食能も低下することが報告されている.TLR(Toll型受容体,Toll-like receptor)のリガンドに応答してサイトカインを分泌する能力も低下していることが報告されているが,興味深いことに,非刺激時のサイトカイン産生の上昇や,特定のリガンドに対する過剰応答もみられ,単に機能が全般的に低下しているのではなく,もっと複雑なシグナル応答機構の選択的な変化が生じていることが示唆されており,免疫老化の二面性を含めた真の意義の解明が待たれるところである(仲島・茶本の稿).
自然免疫系の細胞のなかでもマクロファージは慢性炎症プロセスをリードする重要な役割を担う.マクロファージは従来考えられていた以上に多彩な機能をもつことが明らかとなっており,炎症性サイトカインを分泌して炎症を促進するだけでなく,死細胞のクリアランス,抗炎症性サイトカインの分泌によって炎症を収束させるようにも働く.また,線維化と組織リモデリングも進める.近年のシングルセル解析の進歩により,マクロファージの異質性はより複雑で,きわめて多様な機能・形質に分類されること,組織や病態によりその相違が存在することなどが解明されてきている.例えば,加齢によって,脂肪組織マクロファージのバランスが炎症性のサブポピュレーションに傾くことが報告されている12).中枢の免疫担当細胞として知られ,中枢神経系に存在する常在性マクロファージともよばれるミクログリアについても,ニューロンの数やシナプス形成の制御に重要な役割を担い,その機能障害は自閉症関連疾患の発症にかかわる一方で,その活性化は慢性炎症を誘導し,アルツハイマー型認知機能障害など中枢神経系の病態の発症,進展にかかわるなど,その二面性が知られている.近年の遺伝子発現の網羅的解析から,ミクログリアにおける遺伝子の発現には領域に特異的な多様性が存在すること,領域ごとにミクログリアのターンオーバー率が異なっていること,通常ミクログリアはランダムに自己複製するのに対し,病態においては特定のミクログリアがクローナルに増殖することが示された.ミクログリアの形態もまた,脳の領域によって異なるようで,ミクログリアの多様性には起源の違いもかかわる可能性が示唆されている.ミクログリアと関連する慢性炎症は,まさに加齢に伴い発症リスクが高まる認知症をはじめとするさまざまな中枢神経系疾患の発症,進展の鍵である(赤堀らの稿).
❹ 体細胞変異
人体の細胞のゲノムは,絶えず損傷と修復をくり返している.ゲノムが損傷し,それが適切に修復されない場合,そのダメージはエラー(体細胞変異)として蓄積されていく.血液細胞を対象とした解析では,個々の細胞でゲノム上ランダムに体細胞変異が生じていると想定されるが,変異が残る好発部位が存在し,その多くはTET2,DNMT3a,Jak2など血液がんの原因となる遺伝子変異であり,年齢とともに体細胞変異を有する細胞数は増加する傾向にあり,クローン性造血(clonal haematopoiesis of indeterminate potential:CHIP)として注目されている.特に変異をもつマクロファージ,単球は,IL-1βやIL-6など炎症性サイトカインの発現が高く,加齢に伴う慢性炎症の発生や促進の原因となり,その結果,心不全,骨粗鬆症,閉塞性肺疾患(COPD),肝硬変を増悪すること,抗炎症が加齢関連疾患の予防・治療戦略になることが示されたことは興味深い(菊池・佐野の稿).CHIPと加齢関連疾患の関連において説明可能な変異を有する遺伝子は全体の25%に満たない状況で,さらなる解明が求められている.そのようななか,Y染色体が欠落する細胞も出現し,loss of Y(LOY)として注目されている.特にLOYを示すマクロファージ,単球は,炎症および線維化促進の特徴を有しており,心不全を増悪させることが明らかとなっている13).このような変化は,血液細胞以外の細胞にも生じており,そのためさまざまな組織では,変異のある細胞と変異のない細胞が混在する組織モザイク化を示し,これが老化および加齢関連疾患にどのようにかかわるのか,今後の解明が待たれるところである.
2慢性炎症は抑制すべき?
慢性炎症に伴い異所性(非リンパ組織)に,三次リンパ組織が後天的に形成される.この三次リンパ組織は,加齢に伴い組織の線維化を促進し臓器の機能障害をもたらし,さまざまな加齢関連疾患の発症,進展に寄与することが解明されてきている(谷口らの稿).
尾池グループは,ANGPTL2(angiopoietin-like protein 2)の研究を通して,ANGPTL2は分泌タンパク質であり,本来,組織修復や免疫応答に重要な役割を果たしているが,さまざまな病態の基盤となる組織の環境変化により,その産生/分泌が増大し慢性炎症を誘導し,病態の発症と進展に寄与していることを明らかにしてきた14)15).そのようななか,2009年に京都大学の湊グループが発表した老化T細胞に関する論文のなかで,T細胞の老化表現型獲得に伴い,発現量が数十倍増加するタンパク質のなかにANGPTL2が含まれていた16).さらにANGPTL2は,早老症の1つであるWerner症候群の皮膚線維芽細胞や前述の三次リンパ組織において発現量の高いタンパク質に含まれているため,われわれは,さまざまな病態をもたらすANGPTL2の産生/分泌が増大する組織の環境変化そのものが組織の加齢性変化,いわゆる “老化” と関連しているのではないかと考え,ANGPTL2という分子の観点から,老化に伴う慢性炎症である「inflammaging/炎症老化」の解明研究を進めてきた.その結果,ヒト,マウスでは,個体の老化に伴い,それを構成するさまざまな細胞においてANGPTL2の発現,産生,分泌が増大すること,マウスを対象に行った研究で,増加したANGPTL2は慢性炎症を誘導し,さまざまな加齢関連疾患の発症リスクを高めること,逆にその抑制により,加齢関連疾患の発症リスクを軽減できること,さらにヒトの血液サンプルを用いた研究で,血中ANGPTL2濃度が高いグループ,つまりANGPTL2を高産生/高分泌する細胞を多く含む個体では,将来の糖尿病,心血管疾患など加齢関連疾患の発症リスクや全死亡リスクが高いことを明らかにした.以上より,ANGPTL2というきわめて限定された切り口からではあるが,「inflammaging/炎症老化」に対しては,少なくとも健康長寿に向けては何らかの介入が必要ではないかと考えている.
本年(2023年)6月号のCell誌に「Distinct longevity mechanisms across and within species and their association with aging」が米国を中心とするグループより報告された17).この論文は,最大寿命の異なるさまざまな哺乳動物の複数の臓器における遺伝子発現プロファイルから,通常の老化状態でみられる生物学的特徴,自然経過における長寿生物でみられる生物学的特徴を比較し,さらにマウスを対象にした栄養制限などの介入による寿命延伸でみられる生物学的特徴と比較することにより,老化,自然な長寿,介入による寿命延伸の各機構の相違を解明し,老化の本質解明に迫るものである.本解析により,さまざまな共通機構や異なる機構が明らかとなったが,われわれは独自に論文にあるデータから炎症に関連する経路を抽出し解析すると,通常の老化状態では炎症経路が活性化しており,自然経過における長寿生物ではその経路の活性化がやや減弱していた.さらに介入により寿命延伸されたマウスでは,その経路の活性化は著明に抑制されていた.このことから,やはり炎症は老化に伴うさまざまな生物学的現象を促進するものであることが強く示唆された.
日本における百寿者研究は,1990年代,百寿者が日本国内に3千人程度しかいない時代より,広瀬,新井らが中心となる慶應義塾大学のグループによって牽引されている.そのなかで,当初より高齢者,百寿者,超百寿者を対象に血液中の炎症マーカー等を指標に,長寿に必要な免疫学的特徴に注目した研究が行われており,炎症性変化が心血管疾患の古典的リスク因子やバイオマーカーと独立して生命予後に関連することを見出している.慶應グループは,オミクス解析,シングルセル解析技術を百寿者研究に応用し,白血球テロメア長が短縮しにくいこと,CD4陽性キラーT細胞が多く存在すること,エピジェネティック年齢が若いことなどを見出している.どうやら抗老化治療の臨床応用には,「inflammaging/炎症老化」を標的とすることは欠かせないようだ.(新井の稿)
おわりに
本特集では,近年のオミクス解析やシングルセル解析など科学技術の進歩により解明されてきた「inflammaging/炎症老化」の実態を理解し,老化の本質解明に迫ってみた.「inflammaging/炎症老化」は単一なものではなく,老化に伴い,体の中で生じる多様なシステムの変調が複雑に絡み合いながら進んでいくものであり,この慢性炎症が,細胞/臓器/身体の機能低下をもたらし老化表現型の出現,および加齢関連疾患の発症,進展に寄与していることが明らかとなっている. “老化” は,健康長寿を阻害する疾患の発症リスクを高めるが,その基盤の重要な要素こそ「inflammaging/炎症老化」であることも見えてきた.現時点で,老化や加齢関連疾患に対する抗炎症治療の主な成功例は,高感度hsCRP≥2.0 mg/Lを示す心筋梗塞患者を対象に,心血管疾患の二次予防に向けた抗IL-1β抗体Canakinumab(カナキヌマブ)治療のCANTOS試験である.炎症抑制により動脈硬化性疾患の再発が抑制できたことは画期的なことであり,特にTET2に遺伝子変異を示すCHIPを認める患者群において,その有効性が顕著であったこと(菊池・佐野の稿参照)は,非常に興味深いとともに,今後の老化や加齢関連疾患に対しての抗炎症治療の開発戦略において大きな示唆を与えるものだと考える.
2023年10月2〜4日にカナダのWhistlerで開催されたKeystone Symposia “Immunity and aging” に参加してみると,詳細はここでは述べられないが,「inflammaging/炎症老化」と老化および加齢関連疾患に関連する機構や薬物候補など新たな知見が次々と報告されており,今回の特集で紹介していただいた範囲だけではまだまだ完全カバーには程遠いことを痛感した.特に,高齢者のinflammagingをむしろよいものと捉えた,高齢者に向けたがんの新たな免疫治療薬の開発などたいへん興味深く,本領域がまだまだ進展していることを身近に感じた.本特集をきっかけに,老化を加速させる鍵となる「inflammaging/炎症老化」にさらに注目が集まり,メカニズムの理解とともに,老化をすべての加齢関連疾患の基盤病態と捉えた,新たな治療戦略の開発が進展することを期待している.
文献
- López-Otín C, et al:Cell, 153:1194-1217, doi:10.1016/j.cell.2013.05.039(2013)
- López-Otín C, et al:Cell, 186:243-278, doi:10.1016/j.cell.2022.11.001(2023)
- Baker DJ, et al:Nature, 530:184-189, doi:10.1038/nature16932(2016)
- Tchkonia T, et al:J Clin Invest, 123:966-972, doi:10.1172/JCI64098(2013)
- Muñoz-Espín D & Serrano M:Nat Rev Mol Cell Biol, 15:482-496, doi:10.1038/nrm3823(2014)
- Moiseeva V, et al:Nature, 613:169-178, doi:10.1038/s41586-022-05535-x(2023)
- Eguchi K & Manabe I:J Atheroscler Thromb, 21:629-639, doi:10.5551/jat.22533(2014)
- Arnardottir HH, et al:J Immunol, 193:4235-4244, doi:10.4049/jimmunol.1401313(2014)
- Viola J & Soehnlein O:Semin Immunol, 27:184-193, doi:10.1016/j.smim.2015.03.013(2015)
- Goronzy JJ & Weyand CM:Nat Immunol, 14:428-436, doi:10.1038/ni.2588(2013)
- Dykstra B, et al:J Exp Med, 208:2691-2703, doi:10.1084/jem.20111490(2011)
- Lumeng CN, et al:J Immunol, 187:6208-6216, doi:10.4049/jimmunol.1102188(2011)
- Sano S, et al:Science, 377:292-297, doi:10.1126/science.abn3100(2022)
- Tabata M, et al:Cell Metab, 10:178-188, doi:10.1016/j.cmet.2009.08.003(2009)
- Kadomatsu T, et al:Trends Endocrinol Metab, 25:245-254, doi:10.1016/j.tem.2014.03.012(2014)
- Shimatani K, et al:Proc Natl Acad Sci U S A, 106:15807-15812, doi:10.1073/pnas.0908805106(2009)
- Tyshkovskiy A, et al:Cell, 186:2929-2949.e20, doi:10.1016/j.cell.2023.05.002(2023)
本記事のDOI:10.18958/7381-00001-0001083-00
著者プロフィール
尾池雄一:熊本大学大学院生命科学研究部分子遺伝学講座教授.2007年〜現職,’23年〜熊本大学医学部長(兼任),熊本大学大学院生命科学研究部長(兼任).’05〜’08年 JSTさきがけ「代謝と機能制御」研究員,’10〜’13年最先端・次世代研究「ライフ・イノベーション」研究代表者,’13〜’18年JST/AMED CREST「恒常性」研究代表者,’17〜’19年JST START研究代表者,’23〜’28年AMED CREST「老化」研究代表者.循環器専門医,総合内科専門医,肥満症専門医として生じる老化・加齢関連疾患に対する臨床的問い(clinical question)の解明により,健康寿命延伸の具現化をめざしている.(研究キーワード:恒常性,慢性炎症,老化,ミトコンドリア,ANGPTL)
真鍋一郎:千葉大学大学院医学研究院疾患システム医学講座教授.心不全をはじめとする心血管疾患と多病や疾患連関を器官システム間連携,造血・免疫系,エピジェネティクス,代謝の観点から解き明かすことをめざして研究を行っている.研究室ウェブサイト:https://plaza.umin.ac.jp/manabe