概論
免疫ホットスポットの形成における腫瘍血管の関与
Association of tumor vasculature for constitution of immune hot spot
高倉伸幸
Nobuyuki Takakura:Department of Signal Transduction, Research Institute for Microbial Diseases, Osaka University(大阪大学微生物病研究所情報伝達分野)
近年,免疫チェックポイント阻害剤の台頭により,腫瘍免疫療法に注目が集まってきている.一方で,本免疫療法はすべてのがん患者に対し恩恵をもたらしているわけではない.その理由の一つに,たとえ腫瘍免疫担当細胞が活性化したとしても,腫瘍内に進入できず,その効果が発揮できない状態であることが問題視されている.腫瘍免疫が機能するかどうかを判断する方法として,がん細胞の遺伝子変異やメタボリックな状態,末梢リンパ球数,リンパ球遊走因子の発現などを指標にするImmunogramという方法が報告されてきている.そのなかでも,腫瘍内に形成される,「血管の質」ということをパラメーターにすべきであることが最近特に指摘されるようになってきた.腫瘍内に形成されるべき,腫瘍免疫を活性化させる「血管の質」とは何か?本特集では,「血管と免疫」をキーワードに,基礎医学的および臨床医学的両側面から,血管生物学と腫瘍免疫学の融合した学問の必要性を考えてみたい.
はじめに
腫瘍免疫療法の奏功を考えるうえで重要なことの一つは,いかに免疫細胞が腫瘍組織に到達できるかである.通常の免疫系において,免疫細胞のリンパ節組織内への移動は血管を介して行われ,リンパ節からの全身血液循環へのリエントリーはリンパ節内のリンパ管から,胸管を経由して行われる.血管からのリンパ節内への免疫細胞の侵入は,特殊な構造と機能を有する高内皮細静脈(high endothelial venule;HEV)から生じる.近年,がん組織においても,このようなHEV様の血管が存在することが判明してきており,HEV様血管の量と患者予後の正の相関も判明してきた.HEVの形成は免疫細胞との相互作用により誘導されることも判明してきており,血管細胞と免疫細胞の細胞間相互作用を解析する研究が,がん治療を考えるうえで重要視されてきている.
1腫瘍微小環境研究で注目されている高内皮細静脈(HEV)
免疫細胞のリンパ節への継続的な出入りは,外来異物の監視機構において重要なイベントである.組織間質液から,リンパ管を介してドレナージ(排出)された外来抗原/異物などはリンパ節に搬入される.また,組織において外来抗原によって活性化した樹状細胞(dendritic cell;DC)のような抗原提示細胞も,所属リンパ節に移動してくる.リンパ節では,これらの抗原や抗原提示細胞に反応して,免疫細胞の活性化が生じる.リンパ節にリンパ球を輸入させるのは血管であり,リンパ節内に入り込んだリンパ球は,T細胞の場合傍皮質のT細胞領域に,B細胞において皮質のB細胞領域に,そこから分泌されるCC-chemokine ligand 21(CCL21),CCL19そしてCXC-chemokine ligand 13(CXCL13)によって遊走される.抗原刺激に遭遇しなかったリンパ球は,sphingosine-1-phosphate receptor type 1(S1PR1)のシグナルによってリンパ管に入り,胸管を介して静脈に戻る.マウスの場合,ナイーブB細胞がリンパ節内で抗原を探索する時間は24時間程度といわれており,ナイーブT細胞の12時間まで程度と比べて長い時間,リンパ節に止まる.今回の特集では触れてはいないが,リンパ球のリンパ管へのリターンが交感神経支配を受けていることが最近の話題である1).
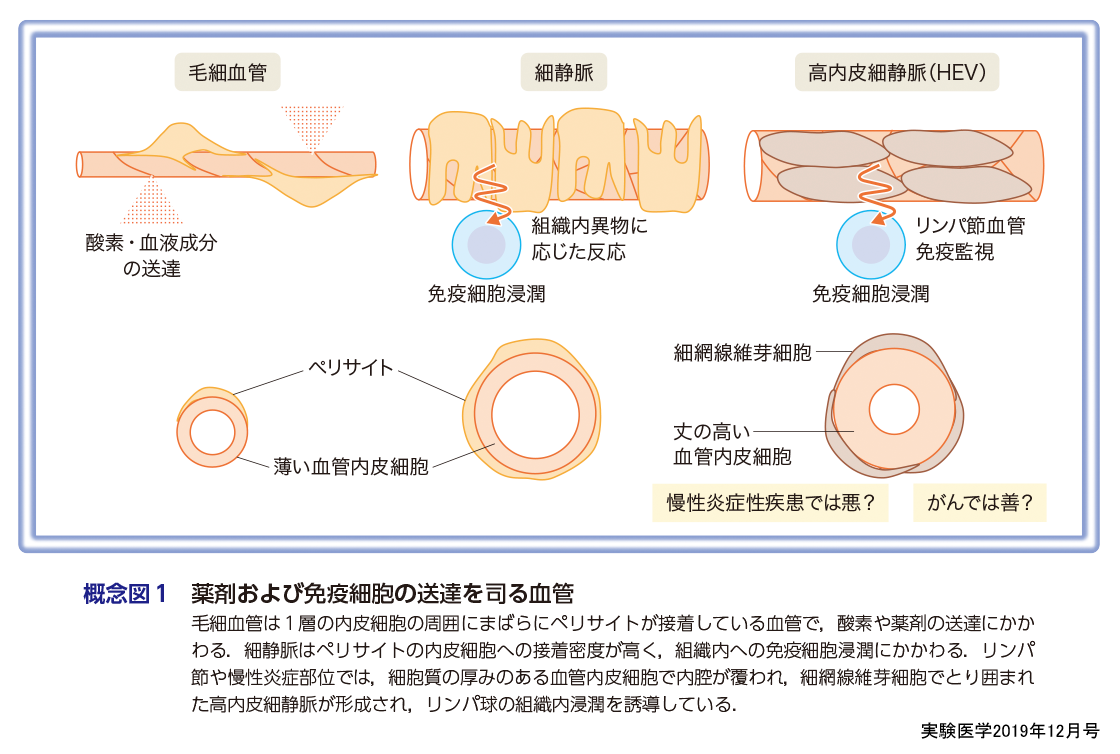
リンパ球をリンパ節内に果敢に侵入させるリンパ節内の血管は通常の組織の細静脈とは形態的にも機能的にもやや異なるHEVである.HEVの血管内皮細胞を覆う壁細胞はペリサイトではなく,細網線維芽細胞が高密度に血管内皮細胞にとり巻いている血管である.他の細静脈とは異なり,細胞質が豊富な丈の高い血管内皮細胞で構築されていることが特徴である(概念図1).HEVの血管内皮細胞はリンパ球ローリングにかかわるL-セレクチンに対するリガンドで,硫酸基およびシアル酸をもつオリゴ糖である6硫酸化シアリルルイスX(sLeX)を発現して,リンパ球を血管内皮細胞上に接着させる.このオリゴ糖は,GlyCAM-1,CD34,endomucin,podocalyxinなどの内皮細胞に発現するコアタンパク質を修飾している.そして,HEVはCCL21,CCL19,CXCL12,CXCL13などのケモカイン(一部は血管内皮細胞そのものが分泌)や,MadCAM-1,ICAM-1などのインテグリンリガンドによって,リンパ球を内皮細胞に強固に接着させ,リンパ節内に引き込むのである.
HEVが腫瘍領域で注目されるようになってきたのは,腫瘍内にリンパ球の浸潤を誘導するホットスポットの存在が判明してきたことによる.免疫チェックポイント機構は,PD-1などを発現するCD4,CD8陽性リンパ球の活性化を抑制し,自己免疫にかかわるシステムであるが,腫瘍免疫を寛容にする機構でもある2).免疫チェックポイント阻害剤の顕著な抗腫瘍効果が報告されるなか,その恩恵に預かれない患者も多く存在する.その理由の一つに,リンパ球がそもそも腫瘍内に浸潤せず,がん細胞への攻撃ができない状態であることが判明してきた.
従来,HEVはリンパ節のような正常組織だけでなく,リウマチ関節炎,炎症性腸疾患,気管支喘息,自己免疫性甲状腺炎,ヘリコバクター胃炎,他多くの慢性炎症性疾患の病変部位にも存在し,リンパ球の組織内浸潤を誘導することで,炎症が遷延する原因であり,この場合HEVの形成を抑制することで病態の是正につながると考えられてきた.しかし,最近になって,メラノーマをはじめ,乳がん,大腸がん,肺がん,卵巣がんなど,がん組織にもHEV様の血管が存在することが報告されてきており,HEV近傍におけるCD8陽性リンパ球の存在も明らかにされ,HEV様血管が多いほど,予後がよいとの臨床成績も報告されてきた3).よって,従来,がんワクチンをはじめとする腫瘍免疫療法の効果が限定的であった理由の一つに,HEV様血管形成の腫瘍内での抑制があり,現在トレンドとなっている免疫チェックポイント阻害剤の効果をさらに高めるためにも,腫瘍内HEV様血管の誘導の重要性が認識されてきたということになる.よって,いかに腫瘍内にHEV様血管を誘導するか.そのためには,免疫細胞と血管内皮細胞の相互作用を明らかにすることが重要となる.
2血液細胞と血管内皮細胞との親密な相互関係
脊椎動物においては全身に張り巡らされる血管が存在し,しかもすべての血管は末梢組織のどの部分にも開放せず,血管内皮細胞で完全にシールされた閉鎖性の血流経路を形成している.内径が5〜10 μmまでの毛細血管では,血管内皮細胞の周りにまばらにペリサイトが接着して,血管構造は脆弱ながらも安定に保たれており,血管内皮細胞間のわずかな間隙から,酸素や必要な体液成分を組織に運搬する(概念図1左).一方で,ペリサイトが密に接着した細静脈は,毛細血管から,血管内皮細胞が血管平滑筋で覆われたいわゆる静脈の間に位置する血管である(概念図1中央).血管内腔は20 μmと太くなり,毛細血管での激しい血流から,突然緩やかな血流に変化する場所である.前述したHEVは恒常的に免疫細胞をリンパ節内に浸潤させるのに対して,細静脈では組織の炎症や異物の侵入に際して反応し,免疫細胞の浸潤に必要な分子の発現を介して,このような流れが急速に遅くなった細静脈から免疫細胞を組織に浸潤させる(概念図1中央).つまり免疫の恒常性は,血管形成により成立しているということになる.
一方で,ショウジョウバエの胚などは,ヘモサイト(hemocyte)とよばれる貪食を担う免疫細胞は存在するのに対し,血管内皮細胞は存在せず,しかもいわゆる血管構造は存在しない.このような生物において血流はどうなっているのか? これは,個体発生の時期での解析であるが,頭部で発生したヘモサイトは,個体発生のプログラム過程で細胞死を生じた領域から,vascular endothelial growth factor(VEGF,脊椎動物では血管内皮細胞に作用して,血管形成にかかわる因子)の相同因子が分泌され,ヘモサイトが発現するVEGF受容体がそれに反応して,遊走が誘導され,これをくり返して,血液の流れができていることが判明している4).つまり,VEGFの作用する細胞は異なるものの,血管をもたない生物であれ,VEGFが血流を誘導するという観点で同じ作用をしていることになり非常に興味深い.
このように,血液と血管は,血流を成立させる細胞という観点で非常に親密な関係にあるが,血液を構成する細胞はもともと血管内皮細胞との共通祖先細胞であるヘマンジオブラスト(近年では,hemogenic angioblastとよばれている)から発生するという発生的な共通点もある.また,いわゆる造血幹細胞は骨髄中では血管領域に存在して,血管内皮細胞との相互作用で,自己複製などの幹細胞性を維持するという血管ニッチの概念も存在する.そして腫瘍におけるHEVの形成を考えていくうえでは非常に重要な点として,血液細胞が血管形成を制御するという相互作用が挙げられる.
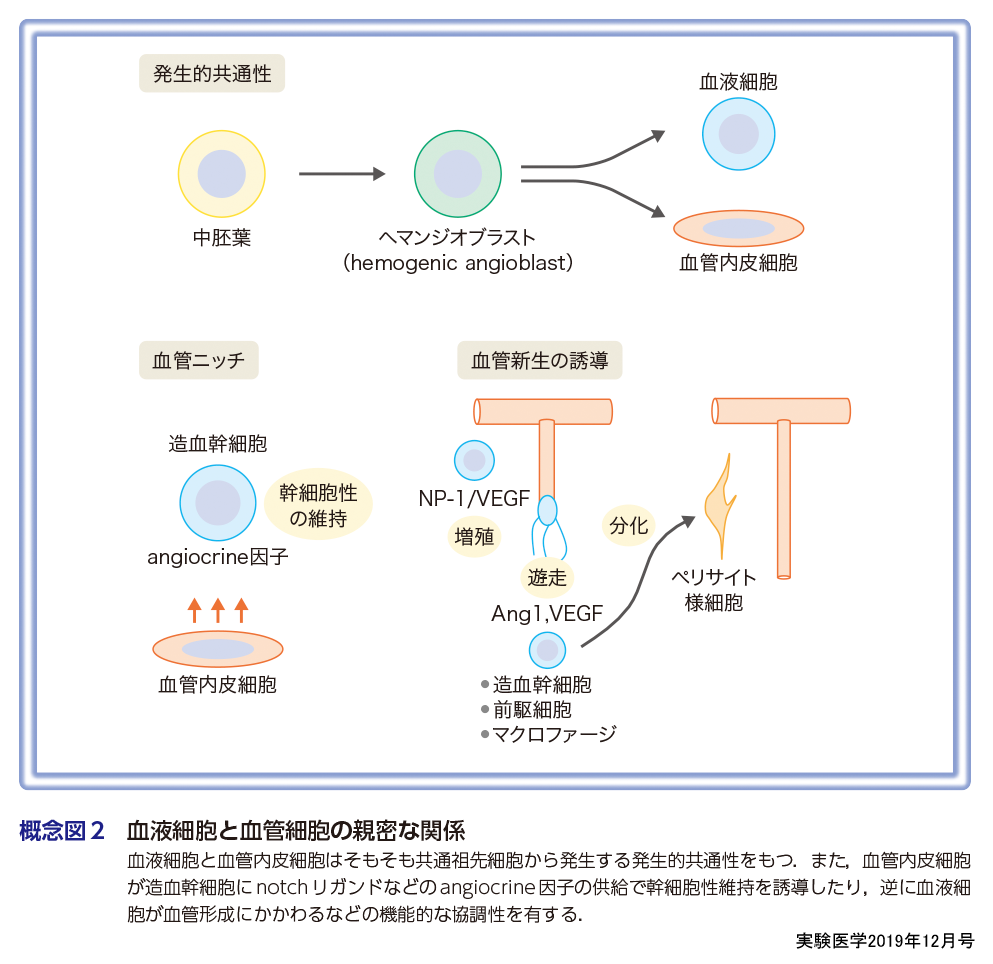
われわれは,造血幹細胞が発生せず胎仔期に致死となる,AML1(acute myeloid leukemia 1 protein)遺伝子の欠損マウスの組織を解析し,肝臓や頭部などで血管網の形成が抑制されていることを発見し,この機序として,造血幹細胞を含めた血液細胞が産生するAngiopoietin-1(Ang1)などの血管系成長因子の関与を見出している5).さらに,VEGFとの関連では,T,Bリンパ球上に発現するVEGF受容体の一つであるNeuropilin-1(NRP1)は,VEGFと結合した状態で,血管内皮細胞に発現するVEGF受容体2(VEGFR2)を活性化させると,VEGF単独に比べ,より強いVEGFR2のリン酸化を誘導することを見出している6).これらの機能は,血管新生の過程で,血管内皮細胞の周囲に存在する血液細胞が血管形成のアクセサリー細胞として機能していることを示唆するものである(概念図2).
下肢の虚血モデルにおいては,透過性の亢進した血管が再生することが知られているが,ここに正常マウスの血液を移植すると,透過性が抑制された血管が誘導されることを見出している.しかし,移植する血液細胞を血管透過性抑制因子として知られるAng1を欠損したマウス由来にすると,透過性の抑制が観察されなくなった.この原因として,骨髄球系の血液細胞を特定の条件で培養すると,ペリサイトの形質に類似した細胞がリプログラミングしてくることも見出していることから,血液細胞は一過性にペリサイト様に分化転換し,Ang1を分泌することで,血管新生時に急速に形成される未成熟な血管の成熟化を誘導しているのではないかと考えられる(概念図2,高倉の各論も参照)7).
3腫瘍内免疫ホットスポットの誘導における免疫細胞の関与
前述のように,血液細胞は血管内皮細胞に働きかけ,血管形成,血管成熟化などに関与しているのではないかと考えられる.では,腫瘍内ではどのような細胞が,どのように血管形成とかかわり,そして免疫ホットスポットをもたらすHEV様血管の形成とかかわるのであろうか? この機序はまだ解明段階であるものの,本特集ではリンパ節で生じるイベントや,マウス腫瘍モデルで明らかにされている知見を紹介する(概念図3).
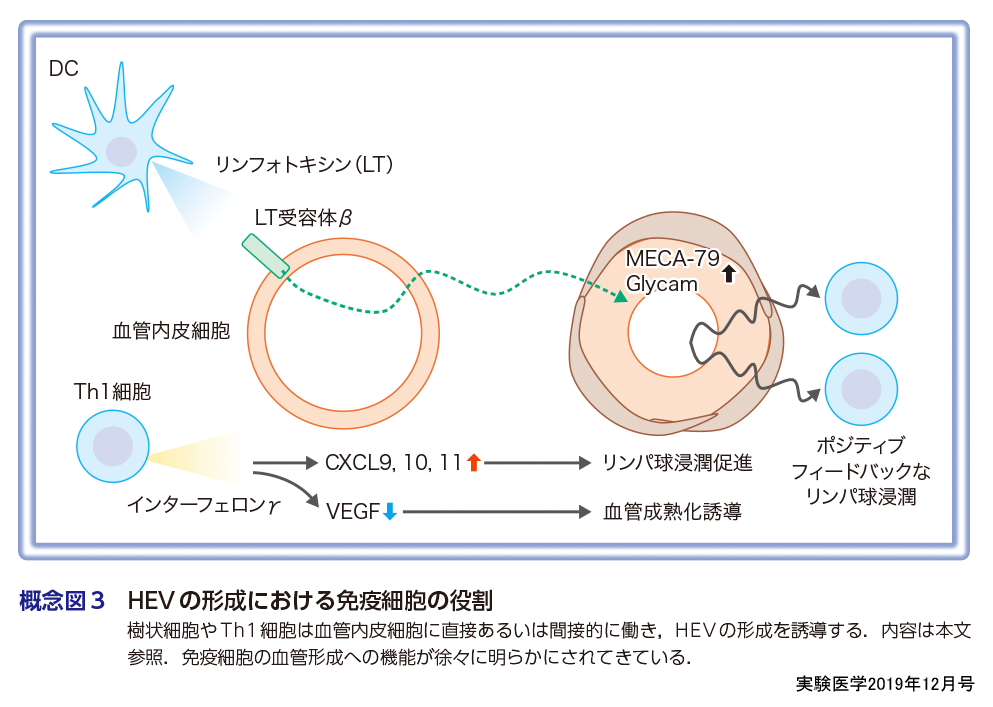
樹状細胞(DC)はがん組織においても観察される免疫細胞であるが,CD11c遺伝子プロモーター制御下にジフテリアトキシン受容体を発現させたマウスを用いて,DCを除去したマウスでは,リンパ球のHEV血管内皮細胞上への接着が抑制され,リンパ節へのリンパ球浸潤の抑制が観察されている8).同様に,ケモカイン受容体であるCCR7を欠損したマウスでも,リンパ節へのリンパ球浸潤が抑制されており,この際,リンパ球にCCR7を戻し直すだけでは,リンパ球浸潤は改善せず,DCとリンパ球の両方にCCR7を戻さないと,リンパ球浸潤が改善しない.つまり,リンパ球のリンパ節内への浸潤にはDCが必要であると結論されている9).また,DCのHEVとの関係性も解析されており,例えば,DCを除去すると,HEV血管内皮細胞の機能性の特徴であるGlycamなどの発現が抑制され,またHEVマーカーとして知られているMECA-79の発現も減弱する.この際,他の血管内皮細胞マーカーであるCD31やVE-cadherinの発現が抑制されているわけではなく,DCがないとHEVの特徴が消失するということになる.この作用は,DCに発現するリンフォトキシンがHEV内皮細胞のリンフォトキシン受容体βを活性化して生じる10).つまり,がん組織に当てはめれば,がん組織においてDCと血管内皮細胞が相互作用できる状態とすれば,HEVの誘導や維持が可能になり,免疫ホットスポットの誘導が可能になるかもしれない.
腫瘍内の未成熟血管の正常化が,腫瘍微小環境を改善し,リンパ球浸潤を促進させることは高倉の各論で詳細に記載しているが,CD4陽性T細胞を腫瘍内で除外したり,その活性化を抑制すると,血管の正常化が抑制される11).逆に,ペリサイトの除去を行うと,腫瘍内T細胞浸潤が抑制される.興味深いことに,血管関連物質の投与でなく,免疫チェックポイント阻害剤でCD4陽性T細胞を活性化させると,ペリサイトの血管内皮細胞への被覆化が進み,腫瘍血管の正常化が生じる.このT細胞のなかでも,インターフェロン(IFN)γを分泌するtype 1ヘルパーT(Th1)細胞が,血管正常化を誘導する細胞であると結論されている.IFNγがVEGFの発現を抑制することで,血管透過性を改善し,血管の正常化につながり,またIFNγはCXCL9,CXCL10,CXCL11の分泌を促進して,リンパ球浸潤を促進させ,またこれらのケモカインがペリサイトの動員にもつながる.さらに,この血管の正常化に伴って,T細胞のなかでも,制御性T細胞は減少し,DCの増加や,好中球の減少も誘導される.つまり,CD4陽性T細胞の活性化が,血管の正常化を介して,腫瘍免疫を改善するというストーリーが報告されている.
DCのリンパ球に対する効果を考えると,T細胞の活性化を誘導するDCが存在して,腫瘍血管と相互作用すれば,あとは腫瘍血管の正常化が誘導され,さらにCD4陽性のT細胞の浸潤で,血管の成熟化がさらに進み,DCも除去されず増加して,HEV様の血管が腫瘍内で誘導されて免疫ホットスポットが形成されるようになるのではないかと考えられる.
おわりに
現在,免疫チェックポイント阻害剤の台頭により,腫瘍免疫療法がトレンドとなってきている.ただし,前述した通り,この治療の恩恵を受ける患者の数はまだ少ない.免疫チェックポイント阻害薬の効果を判定するために,腫瘍内のリンパ球の量や質をあらかじめ認識しておくという,Immunoscore解析も行われつつある12).このような解析から,免疫が作用するためには,がん組織における微小環境の免疫環境を改善する必要があることが浮き彫りになってきた.それに対し,免疫細胞と血管細胞との相互作用によって,腫瘍免疫の効果をさらに高められる可能性があり,そのためにも血管生物学と免疫学を融合した学問によるさらなる詳細な解析が必要である.今回は,血管生物学の研究者から,腫瘍免疫を眺めてみること(高倉の各論,樋田・間石の稿),逆に免疫学側から血管を考えるという立場でそれぞれ2名の研究者に寄稿をいただいた(長友の稿,清水らの稿).また,実際にがん治療に携わる臨床家の視点で,腫瘍免疫と血管形成を考察していただいた(横井・木島の稿,田中・田村の稿).このような,企画をもとに,それぞれに異なる学問の単なる足し算ではなく,新たな概念を創出する学問が創設されてくることを期待する.
文献
- Suzuki K, et al:J Exp Med, 213:2567-2574, 2016
- Chen DS & Mellman I:Nature, 541:321-330, 2017
- Martinet L, et al:Cancer Res, 71:5678-5687, 2011
- Cho NK, et al:Cell, 108:865-876, 2002
- Takakura N, et al:Cell, 102:199-209, 2000
- Yamada Y, et al:Blood, 101:1801-1809, 2003
- Yamada Y & Takakura N:J Exp Med, 203:1055-1065, 2006
- Moussion C & Girard JP:Nature, 479:542-546, 2011
- Wendland M, et al:Immunity, 35:945-957, 2011
- Browning JL, et al:Immunity, 23:539-550, 2005
- Tian L, et al:Nature, 544:250-254, 2017
- Pagès F, et al:Lancet, 391:2128-2139, 2018
著者プロフィール
高倉伸幸:1997年京都大学大学院医学研究科博士課程修了.医学博士.同年4月より,熊本大学医学部,発生医学研究所で助手,講師,助教授を経て,2001年金沢大学がん研究所教授.’06年より大阪大学微生物病研究所教授.組織幹細胞の維持機構や血管新生の分子機序の解明を介して,腫瘍血管制御,組織再生の医療応用をめざしている.